痛みに関する研究

麻酔は鎮痛・鎮静(意識消失)・不動化(筋弛緩)・有害反射の防止の4つの要素から構成されていますが、その中でも特に手術の痛みを制御することが重要であることは、いわゆる局所麻酔でもある程度の手術侵襲に対抗できることから明らかです。痛みの制御を行うには、どのような仕組みで侵害刺激が痛みとして感知されるのか、その仕組みから解き明かしていく必要があると考えています。痛みの治療法を創設する、ということが麻酔科医の永遠の夢であることは多くの麻酔科医が認めるところだと思いますが、一足飛びに目標は達成できません。困難な問題に立ち向かうには、その要素を分解し、一つ一つ解き明かしていくことが必要です。痛みについての記述(図1)を行った哲学者ルネ・デカルトは「困難は分割せよ」と言いましたが、正に基礎研究とは困難な問題を要素に分割し、玉ねぎの皮を剥くように少しずつ解明していくことにあると思います。
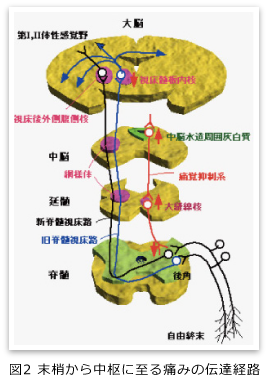
人間は最終的には大脳で痛みを感覚として認知していますが、体のある部分に加わった刺激が、大脳に達し痛みとして感知される情報の伝達経路に脊髄という場所があります(図2)。脊髄には痛み情報を中継する構造があり、その中継地点には痛みの情報を強めたり弱めたりする調節機構が備わっていて、状況によって痛みを弱めたり、逆に痛みを強めたりすることがわかっています。
私たちはこれまで、パッチクランプ法という手法でネズミの脊髄における痛みの伝達様式やそれに関与する物質の神経伝達に及ぼす影響、薬理学的な検討などを行い、世界に誇るべき成果を挙げてきました。特に、脊髄において痛みの伝達を修飾する神経伝達物質のシナプス伝達に対する作用、麻薬性鎮痛薬のシナプス伝達に対する作用、局所麻酔薬の作用などです。これらの研究から、脊髄における痛みの伝達様式や痛みの治療薬として使われる薬剤がどのようにして痛みを制御するのかの一部が明らかになってきました。当教室は今までも、他教室や外国からの研究者を積極的に迎え入れ、研究成果を挙げてきた実績があり、脊髄の電気生理を学ぶことができる国内拠点の一つとなっています。

当研究室では、これらの業績を土台にし、より詳細な研究を進めると同時に、生きたままのネズミに対してパッチクランプ法を適応し、組織ではなく生体としての痛みの伝達様式を解明する研究(in vivoパッチクランプ)、生きた状態のネズミの脳や脊髄における痛みの伝達を可視化するフラビン蛋白蛍光イメージング法を用いた研究を行っています。特にフラビン蛋白蛍光イメージング方を用いた研究は、臨床の教室では国内で当教室のみが行っている研究手法で、神経組織の表層に限定されますが、二次元的な神経興奮の広がりを評価できる点で、これまでの研究手法の限界を超えることができると期待されています。また、馬場教授ご自身は脊髄スライス標本を用いた細胞内カルシウム濃度イメージングの手法を用いて、脊髄における痛みの伝達の2次元的解析を行っています。 これらの研究に組み合わせて、行動学的・組織学・生化学的検討が可能となったため、より多角的な疼痛研究が行えるようになりました。最近はオピオイドに関する研究、下行性疼痛抑制系に関する研究にも力を入れており、徐々にですが成果が上がってきています。
脊髄虚血に関する研究
痛み研究で紹介したパッチクランプの手法は、脊髄虚血に関する研究にも応用できます。脊髄前角細胞は神経細胞の中でも低酸素に弱い細胞であることが知られており、脊髄障害の際に脱落しやすい細胞であることが知られています。その前角細胞に対して直視下にパッチクランプを行うことができます。虚血状態を模した状況で、脊髄前角細胞が障害される機序、脊髄障害に対する麻酔薬やその他の薬物の影響などを検討しています。
また、当教室は脊髄誘発電位に関する多くの研究業績を有しており、特に波形成分の起源および麻酔薬の影響について国内外に発信し続けてきた歴史があります。1971年に下地恒毅前教授がカテーテル電極を硬膜外腔に留置することにより、脊髄誘発電位を導出することに初めて成功しました。四肢電気刺激によって得られる脊髄誘発電位には、segmental
spinal cord potential (seg-SCP)とheterosegmental slow positive wave (HSP)があります。seg-SCP
はラットの前趾(または後趾)刺激により、その所属する脊髄分節から導出され、尖鋭な陰性波と緩徐な陽性波から構成されます。HSPは前趾(または後趾)刺激で腰膨大部(または頸膨大部)に認められる潜時15-30
ms、持続時間40-80 msの陽性波で、上位中枢を介し反射性に駆動された下行性電位です。近年、各波の電位は麻酔薬のみならず脊髄侵襲によっても影響を受けることが解明されました。この成果を礎にして周術期の脊髄保護の研究にも取り組み、基礎研究に留まることなく、臨床で実用化され、新しい医療の発展に貢献するtranslational
researchになることを目標としています。
麻酔薬の作用機序に関する研究
全身麻酔とは、手術に伴う痛みや苦痛を取り除くために特殊な薬剤(麻酔薬)を使い、脳や脊髄などの中枢神経の機能を抑制することにより、意識喪失 (催眠作用)・無痛(鎮痛作用)・筋弛緩(不動化作用)などを含むマルチコンポーネント状態を作り出すものです。世界最初の近代全身麻酔は、Mortonが1846年にマサチューセッツ総合病院にて行ったエーテル麻酔です。エーテルを吸入させることにより、患者を無意識な状態にし、手術の苦痛を取り除くことに成功しました。この後、麻酔薬・麻酔方法の発展があり、それは外科系各科だけではなく、医療分野全体の発展に大きく貢献しています。
しかし、全身麻酔薬がどのようにして中枢神経系に作用しているかについては、まだ分かっていないことが多数あります。特に、全身麻酔が脳のどの部分を標的にしているのかについてはまだはっきりとしていませんし、麻酔と睡眠の違いについてもまだまだ研究の余地があります。当研究室ではウイルスベクターを用いた遺伝子導入法を用いて、薬剤により狙った神経群の活性を任意に操作できる技術を用いて全身麻酔薬がどのようにして脳機能を制御するのか、吸入麻酔薬と静脈麻酔薬の聞き方の違いはなぜ生じるのかを新潟大学脳研究所システム脳病態分野の上野将紀教授と共同で研究しています。また、麻酔と鎮痛は密接に関与していることが知られていますが、この研究から麻酔による意識の消失と痛みによる意識の修飾についての関連が明らかになることも期待されます。
我々の行っている基礎研究は痛みや麻酔や痛みの治療薬がどのようにして痛みに効いているのかを明らかにするという、神経系に特化したものですが、いずれも臨床上の疑問から生じたものを解明しようとする、いわゆるbed
to benchの方向での研究です。将来的にはbench to bedの研究も行えるように体制強化を図っていきたいと考えています。我々の研究に興味・関心がございましたら、ぜひご連絡ください。
- 1.分子生物学的アプローチ
全身麻酔薬は、神経細胞にある神経伝達物質のイオンチャネルに作用すると考えられています。イオンチャネルは、様々なサブユニットの組み合わせで構成されています。私たちの教室では、本学脳研究所細胞神経生物学分野の﨑村建司教授のご協力のもと、ノックアウトマウス(特定のサブユニットを欠損させたマウス)を用いて、全身麻酔薬の作用機序を探る研究を行っています。具体的な方法としては、吸入麻酔薬及び静脈麻酔薬の催眠作用に関しては、立ち直り反射の有無を評価する方法で、吸入麻酔薬の不動化作用に関してはminimum alveolar concentration (MAC)(マウスの尻尾を挟んだ時に動かない最小肺胞内濃度)を測定することで調べています。全身麻酔薬の鎮痛作用に関してはプランターテスト(熱刺激)やランダルセリットテスト(機械的刺激)などの方法で調べています。これらの研究は、麻酔作用に優れ、かつ副作用の少ない麻酔薬の開発へとつながります。 - 2.薬理学的アプローチ
麻酔薬は個々の神経細胞の機能や神経回路を変化させ、その作用を発揮すると考えられています。しかし、神経回路は非常に複雑であるため、様々な内・外因性の影響(睡眠不足、ストレス、内服している薬など)を受けやすいことが知られています。神経回路に変化をきたす物質をニューロモジュレーターといいますが、これらは全身麻酔管理に悪影響を及ぼすこともあります。私たちの教室では野生型マウスを用いて麻酔薬の催眠・不動化作用などに対する様々なニューロモジュレーターの影響を研究しています。前述の立ち直り反射やMACの測定などの手法を用いています。これらの研究は、より質の高い、そしてより安全な全身麻酔管理へとつながります。
私たちの行っている基礎研究に関して、興味・関心がありましたら、ぜひご連絡下さい。
業績
Sasaki M, Kamiya Y, Bamba K, Onishi T, Matsuda K, Kohno T, Kurabe M, Furutani
K, Yanagimura H. Serotonin Plays a Key Role in the Development of Opioid-Induced
Hyperalgesia in Mice. J Pain. 2021 Jan 16:S1526-5900(21)00004-3.
Ohashi N, Kohno T. Analgesic Effect of Acetaminophen: A Review of Known
and Novel Mechanisms of Action. Front Pharmacol. 2020 Nov 30;11:580289.
Onishi T, Watanabe T, Sasaki M, Kamiya Y, Horie M, Tsukano H, Hishida R,
Kohno T, Takebayashi H, Baba H, Shibuki K. Acute spatial spread of NO-mediated
potentiation during hindpaw ischaemia in mice. J Physiol. 2019 Jul;597(13):3441-3455.
Yamamoto G, Kamiya Y, Sasaki M, Ikoma M, Baba H, Kohno T. Neurosteroid
dehydroepiandrosterone sulphate enhances pain transmission in rat spinal
cord dorsal horn. Br J Anaesth. 2019 Aug;123(2):e215-e225.
Shoji H, Ohashi M, Hirano T, Watanabe K, Endo N, Baba H, Kohno T. Mechanisms
of noradrenergic modulation of synaptic transmission and neuronal excitability
in ventral horn neurons of the rat spinal cord. Neuroscience. 2019 Jun
1;408:161-176.
Ohashi N, Ohashi M, Baba H. Action of Norepinephrine on Lamina X of the
Spinal Cord. Neuroscience. 2019 Jun 1;408:214-225.
Seino Y, Ohashi N, Kohno T. The endogenous agonist, β-alanine, activates
glycine receptors in rat spinal dorsal neurons. Biochem Biophys Res Commun.
2018 Jun 12;500(4):897-901.
Ishii H, Petrenko AB, Sasaki M, Satoh Y, Kamiya Y, Tobita T, Furutani K,
Matsuhashi M, Kohno T, Baba H. Free radical scavenger edaravone produces
robust neuroprotection in a rat model of spinal cord injury. Brain Res.
2018 Mar 1;1682:24-35.
Ohashi N, Uta D, Sasaki M, Ohashi M, Kamiya Y, Kohno T. Acetaminophen Metabolite
N-Acylphenolamine Induces Analgesia via Transient Receptor Potential Vanilloid
1 Receptors Expressed on the Primary Afferent Terminals of C-fibers in
the Spinal Dorsal Horn. Anesthesiology. 2017 Aug;127(2):355-371.
Petrenko AB, Baba H. A Rising Tide Lifts All Boats: Increased Ventilation
May Be Involved in Accelerated Recovery from Isoflurane Anesthesia after
Flumazenil Administration. Anesthesiology. 2017 Feb;126(2):351-352.
Baba H, Petrenko AB, Fujiwara N. Clinically relevant concentration of pregabalin
has no acute inhibitory effect on excitation of dorsal horn neurons under
normal or neuropathic pain conditions: An intracellular calcium-imaging
study in spinal cord slices from adult rats. Brain Res. 2016 Oct 1;1648(Pt
A):445-458.
Ohashi M, Hirano T, Watanabe K, Shoji H, Ohashi N, Baba H, Endo N, Kohno
T. Hydrogen peroxide modulates neuronal excitability and membrane properties
in ventral horn neurons of the rat spinal cord. Neuroscience. 2016 Sep
7;331:206-20.
Kurabe M, Furue H, Kohno T. Intravenous administration of lidocaine directly
acts on spinal dorsal horn and produces analgesic effect: An in vivo patch-clamp
analysis. Sci Rep. 2016 May 18;6:26253. Ohashi M, Hirano T, Watanabe K,
Katsumi K, Ohashi N, Baba H, Endo N, Kohno T. Hydrogen peroxide modulates
synaptic transmission in ventral horn neurons of the rat spinal cord. J
Physiol. 2016 Jan 1;594(1):115-34.
Ohashi N, Sasaki M, Ohashi M, Kamiya Y, Baba H, Kohno T. Tranexamic acid
evokes pain by modulating neuronal excitability in the spinal dorsal horn.
Sci Rep. 2015 Aug 21;5:13458.
Watanabe T, Sasaki M, Komagata S, Tsukano H, Hishida R, Kohno T, Baba H,
Shibuki K. Spinal mechanisms underlying potentiation of hindpaw responses
observed after transient hindpaw ischemia in mice. Sci Rep. 2015 Jul 13;5:11191.
Petrenko AB, Furutani K, Baba H. More solid evidence is required to validate
a hypergravity-induced increase in sensitivity to propofol. Anesth Analg.
2014 Nov;119(5):1220.
Petrenko AB, Yamazaki M, Sakimura K, Kano M, Baba H. Augmented tonic pain-
related behavior in knockout mice lacking monoacylglycerol lipase, a major
degrading enzyme for the endocannabinoid 2-arachidonoylglycerol. Behav
Brain Res. 2014 Sep 1;271:51-8.
Honda H, Baba H, Kohno T. The mu opioid receptor activation does not affect
ischemia-induced agonal currents in rat spinal ventral horn. J Anesth.
2014 Dec;28(6):839-45.
Petrenko AB, Watanabe T, Baba H. Hypnotic effect of propofol and hypothalamic
nuclei: are we barking up the right neurocircuitry? Anesth Analg. 2014
Feb;118(2):484.
Petrenko AB, Yamakura T, Sakimura K, Baba H. Defining the role of NMDA
receptors in anesthesia: are we there yet? Eur J Pharmacol. 2014 Jan 15;723:29-37.
Ishii H, Petrenko AB, Kohno T, Baba H. No evidence for the development
of acute analgesic tolerance during and hyperalgesia after prolonged remifentanil
administration in mice. Mol Pain. 2013 Mar 7;9:11.
Petrenko AB, Yamakura T, Kohno T, Sakimura K, Baba H. Increased brain monoaminergic
tone after the NMDA receptor GluN2A subunit gene knockout is responsible
for resistance to the hypnotic effect of nitrous oxide. Eur J Pharmacol.
2013 Jan 5;698(1-3):200-5.
Honda H, Kawasaki Y, Baba H, Kohno T. The mu opioid receptor modulates
neurotransmission in the rat spinal ventral horn. Anesth Analg. 2012 Sep;115(3):703-12.
Yamamoto T, Honda H, Baba H, Kohno T. Effect of xenon on excitatory and
inhibitory transmission in rat spinal ventral horn neurons. Anesthesiology.
2012 May;116(5):1025-34.
Honda H, Baba H, Kohno T. Electrophysiological analysis of vulnerability
to experimental ischemia in neonatal rat spinal ventral horn neurons. Neurosci
Lett. 2011 Apr 25;494(2):161-4.
Georgiev SK, Furue H, Baba H, Kohno T. Xenon inhibits excitatory but not
inhibitory transmission in rat spinal cord dorsal horn neurons. Mol Pain.
2010 May 5;6:25.
Seo K, Seino H, Yoshikawa H, Petrenko AB, Baba H, Fujiwara N, Someya G,
Kawano Y, Maeda T, Matsuda M, Kanematsu T, Hirata M. Genetic reduction
of GABA(A) receptor gamma2 subunit expression potentiates the immobilizing
action of isoflurane. Neurosci Lett. 2010 Mar 12;472(1):1-4.
Furutani K, Ikoma M, Ishii H, Baba H, Kohno T. Bupivacaine inhibits glutamatergic
transmission in spinal dorsal horn neurons. Anesthesiology. 2010 Jan;112(1):138-43.
Petrenko AB, Yamakura T, Kohno T, Sakimura K, Baba H. Reduced immobilizing
properties of isoflurane and nitrous oxide in mutant mice lacking the N-methyl-
D-aspartate receptor GluR(epsilon)1 subunit are caused by the secondary
effects of gene knockout. Anesth Analg. 2010 Feb 1;110(2):461-5.
Georgiev SK, Baba H, Kohno T. Nitrous oxide and the inhibitory synaptic
transmission in rat dorsal horn neurons. Eur J Pain. 2010 Jan;14(1):17-22.
Petrenko AB, Kohno T, Wu J, Sakimura K, Baba H. Spontaneous hyperactivity
in mutant mice lacking the NMDA receptor GluRepsilon1 subunit is aggravated
during exposure to 0.1 MAC sevoflurane and is preserved after emergence
from sevoflurane anaesthesia. Eur J Anaesthesiol. 2008 Dec;25(12):953-60.
Ishii H, Kohno T, Yamakura T, Ikoma M, Baba H. Action of dexmedetomidine
on the substantia gelatinosa neurons of the rat spinal cord. Eur J Neurosci.
2008 Jun;27(12):3182-90.
Wu J, Kohno T, Georgiev SK, Ikoma M, Ishii H, Petrenko AB, Baba H. Taurine
activates glycine and gamma-aminobutyric acid A receptors in rat substantia
gelatinosa neurons. Neuroreport. 2008 Feb 12;19(3):333-7.
Ikoma M, Kohno T, Baba H. Differential presynaptic effects of opioid agonists
on Adelta- and C-afferent glutamatergic transmission to the spinal dorsal
horn. Anesthesiology. 2007 Nov;107(5):807-12.
Petrenko AB, Tsujita M, Kohno T, Sakimura K, Baba H. Mutation of alpha1G
T-type calcium channels in mice does not change anesthetic requirements
for loss of the righting reflex and minimum alveolar concentration but
delays the onset of anesthetic induction. Anesthesiology. 2007 Jun;106(6):1177-85.
Georgiev SK, Kohno T, Ikoma M, Yamakura T, Baba H. Nitrous oxide inhibits
glutamatergic transmission in spinal dorsal horn neurons. Pain. 2008 Jan;134(1-2):24-31.
Ogawa M, Takamatsu M, Okamoto M, Baba H, Seo K, Fujiwara N. Iteration of
high-frequency stimulation enhances long-lasting excitatory responses in
the spinal dorsal horn of rats: characterization by optical imaging of
signal propagation. Neurosci Res. 2007 Mar;57(3):467-72.
Kohno T, Wakai A, Ataka T, Ikoma M, Yamakura T, Baba H. Actions of midazolam
on excitatory transmission in dorsal horn neurons of adult rat spinal cord.
Anesthesiology. 2006 Feb;104(2):338-43.
Petrenko AB, Yamakura T, Askalany AR, Kohno T, Sakimura K, Baba H. Effects
of ketamine on acute somatic nociception in wild-type and N-methyl-D-aspartate
(NMDA) receptor epsilon1 subunit knockout mice. Neuropharmacology. 2006
May;50(6):741-7.
Georgiev SK, Wakai A, Kohno T, Yamakura T, Baba H. Actions of norepinephrine
and isoflurane on inhibitory synaptic transmission in adult rat spinal
cord substantia gelatinosa neurons. Anesth Analg. 2006 Jan;102(1):124-8.
Askalany AR, Yamakura T, Petrenko AB, Kohno T, Sakimura K, Baba H. Effect
of agmatine on heteromeric N-methyl-D-aspartate receptor channels. Neurosci
Res. 2005 Aug;52(4):387-92.
Yamakura T, Askalany AR, Petrenko AB, Kohno T, Baba H, Sakimura K. The
NR3B subunit does not alter the anesthetic sensitivities of recombinant
N-methyl-D- aspartate receptors. Anesth Analg. 2005 Jun;100(6):1687-92.
Wakai A, Kohno T, Yamakura T, Okamoto M, Ataka T, Baba H. Action of isoflurane
on the substantia gelatinosa neurons of the adult rat spinal cord. Anesthesiology.
2005 Feb;102(2):379-86.
Petrenko AB, Yamakura T, Fujiwara N, Askalany AR, Baba H, Sakimura K. Reduced
sensitivity to ketamine and pentobarbital in mice lacking the N-methyl-
D-aspartate receptor GluRepsilon1 subunit. Anesth Analg. 2004 Oct;99(4):1136-40,
Baba H, Ji RR, Kohno T, Moore KA, Ataka T, Wakai A, Okamoto M, Woolf CJ.
Removal of GABAergic inhibition facilitates polysynaptic A fiber-mediated
excitatory transmission to the superficial spinal dorsal horn. Mol Cell
Neurosci. 2003 Nov;24(3):818-30.
Petrenko AB, Yamakura T, Baba H, Shimoji K. The role of N-methyl-D-aspartate
(NMDA) receptors in pain: a review. Anesth Analg. 2003 Oct;97(4):1108-16.
Wu C, Fujihara H, Yao J, Qi S, Li H, Shimoji K, Baba H. Different expression
patterns of Bcl-2, Bcl-xl, and Bax proteins after sublethal forebrain ischemia
in C57Black/Crj6 mouse striatum. Stroke. 2003 Jul;34(7):1803-8.
Petrenko AB, Yamakura T, Baba H, Sakimura K. Unaltered pain-related behavior
in mice lacking NMDA receptor GluRepsilon 1 subunit. Neurosci Res. 2003
Jun;46(2):199-204.
Zhan RZ, Fujihara H, Baba H, Yamakura T, Shimoji K. Ischemic preconditioning
is capable of inducing mitochondrial tolerance in the rat brain. Anesthesiology.
2002 Oct;97(4):896-901.
(紙谷義孝、石井秀明、Andrey Petrenko、古谷健太)